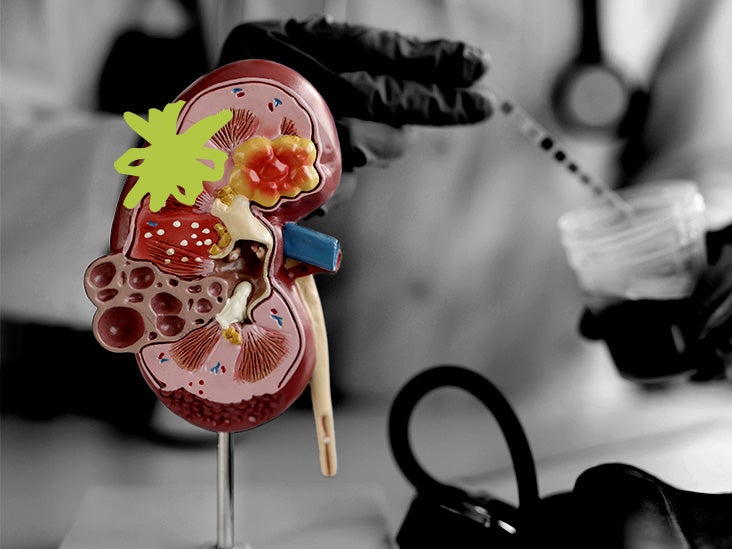
- يتطلب الأداء الطبيعي للكلى مستويات عالية من الطاقة وتتميز أمراض الكلى باضطراب استقلاب الطاقة.
- نيكوتيناميد الأدينين ثنائي النوكليوتيد (NAD) هو جزيء يلعب دورًا رئيسيًا في استقلاب الطاقة والإشارات الخلوية ، مع دراسات تشير إلى تغييرات في استقلاب NAD مع أمراض الكلى.
- تشير دراسة جديدة أجريت على عينات من الكلى من البشر والفئران إلى أن نقص NAD يلعب دورًا رئيسيًا في التوسط في الالتهاب والتغيرات الأيضية التي لوحظت في أمراض الكلى.
- تشير الدراسة أيضًا إلى أن المكملات مع السلائف التي يستخدمها الجسم لتخليق NAD ساعدت في حماية الفئران من أمراض الكلى.
- يمكن أن تساعد هذه النتائج في تطوير علاجات لأمراض الكلى.
أ
علاوة على ذلك ، يقول الباحثون إنهم وجدوا أن الاستخدام التكميلي للسلائف أو لبنات البناء لتخليق NAD يمكن أن يعيد مستويات NAD ويساعد على منع إصابة الكلى في الفئران.
تم التوسط في هذه التأثيرات الوقائية لسلائف NAD على صحة الكلى عن طريق تخفيف الخلل الوظيفي في الميتوكوندريا ، وبالتالي تقليل الالتهاب وتلف الكلى.
قال الدكتور كاتالين سوسزتاك ، مؤلف الدراسة وأستاذ الطب: “(تكشف دراستنا) أن المرضى الذين يعانون من أمراض الكلى ، وكذلك نماذج الفئران لأمراض الكلى ، تظهر مستويات منخفضة من نيكوتيناميد الأدينين ثنائي النوكليوتيد (NAD) في الكلى”. في جامعة بنسلفانيا.
وقالت: “تشير النتائج إلى وجود صلة محتملة بين نقص NAD وتطور أمراض الكلى” أخبار طبية اليوم. علاوة على ذلك ، وجدت الدراسة أن تناول الفئران بالنيكوتيناميد ريبوسيد (NR) والنيكوتيناميد أحادي النوكليوتيد (NMN) يحميها من تطور أمراض الكلى. NR و NMN هما سلائف لـ NAD وقد ثبت أنهما يعززان مستويات NAD في الأبحاث السابقة. “
أثارت النتائج الواعدة من نماذج الفئران اهتمامًا بإجراء مزيد من الدراسات للتحقيق في الفوائد المحتملة لمكملات NR و NMN للمرضى الذين يعانون من أمراض الكلى. من خلال تحليل تأثيرات هذه المكملات على البشر ، يأمل الباحثون في اكتساب فهم أفضل لإمكانياتهم العلاجية وما إذا كان بإمكانهم التخفيف بشكل فعال من تطور مرض الكلى وتطوره “.
ال
يتم إجراء هذه العمليات من قبل
يتكون كل من حوالي مليون نيفرون موجود في الكلى من هيكل يشبه الكوب يسمى الكبيبة ونظام أنبوبي معقد. يتم ترشيح الدم في البداية في الكبيبة ثم يمر الترشيح الفائق الذي يتكون من الماء والجزيئات الصغيرة في الأنابيب الكلوية.
تشارك الأنابيب الكلوية في إعادة امتصاص العناصر الغذائية والجزيئات الصغيرة المفيدة الأخرى في مجرى الدم مع التخلص من الفضلات والسموم عن طريق البول. هذه العمليات كثيفة الطاقة والتعرض للسموم أو الحرمان من الأكسجين يمكن أن يؤدي إلى تعطيل استقلاب الطاقة في الأنابيب الكلوية.
الميتوكوندريا هي عضيات خلوية مسؤولة عن تحويل العناصر الغذائية إلى طاقة كيميائية مطلوبة لجميع العمليات الخلوية. تمشيا مع ارتفاع الطلب على الطاقة ، تمتلك الكلى عددًا كبيرًا من الميتوكوندريا.
أظهرت الدراسات السابقة أن أمراض الكلى مرتبطة بـ
يمكن إنتاج NAD من جديد عبر ملف من جديد مسار التوليف باستخدام التربتوفان من الأحماض الأمينية. بالإضافة إلى ذلك ، يمكن أيضًا إعادة تدوير NAD عبر مسار الإنقاذ من النيكوتيناميد (NAM) والنيكوتيناميد ريبوسيد (NR). يتم تحويل NAM و NR إلى أحادي نيوكليوتيد النيكوتيناميد (NMN) ، والذي يتم تحويله لاحقًا إلى NAD.
الدراسات في القوارض لها
ومع ذلك ، فإن الآليات الكامنة وراء تصرفات سلائف NAD في الأفراد المصابين بأمراض الكلى ليست مفهومة جيدًا. في هذه الدراسة ، درس الباحثون أيضًا كيف تساهم التغيرات في استقلاب NAD في الإصابة بأمراض الكلى.
اشتملت الدراسة على عينات من الكلى من 25 شخصًا يعانون من أمراض الكلى الناتجة عن مرض السكري أو ارتفاع ضغط الدم.
قارن الباحثون الاختلافات في التعبير عن المستقلبات ، وهي الوسيطة أو المنتجات الثانوية لعملية التمثيل الغذائي ، والجينات في عينات الأفراد المصابين بأمراض الكلى مع تلك التي تم الحصول عليها من 25 فردًا لا يعانون من أمراض الكلى.
أفاد الباحثون أن مسار NAD كان خاضعًا للتنظيم في الأفراد المصابين بأمراض الكلى ، حيث أظهر مستويات أقل من NAD و NR و NAM. ومع ذلك ، لم يظهر الأفراد المصابون بأمراض الكلى مستويات أقل من NMN. بالإضافة إلى هذه التغييرات في مسار إنقاذ NAD ، يقول الباحثون إنهم وجدوا أيضًا تغييرات في من جديد مسار التوليف.
كشفت دراسات التعبير الجيني أن مستويات تعبير NAD كانت مرتبطة بشكل إيجابي بمستويات التعبير عن الجينات المشاركة في المسارات الأيضية في الميتوكوندريا. بالإضافة إلى ذلك ، ارتبطت مستويات التعبير الجيني المنخفضة لـ NAD بمستويات أعلى من الجين المتورط في موت الخلايا ، المعروف أيضًا باسم موت الخلايا المبرمج.
ثم قام الباحثون بفحص ما إذا كان قد لوحظت تغييرات مماثلة في الفئران مع أو بدون إصابة في الكلى. قام الباحثون بحقن الفئران بعقار العلاج الكيميائي
أظهرت الفئران المصابة بإصابة في الكلى أيضًا مستويات أقل من NAD وتغيرات في المستقلبات المشاركة في مسارات تخليق NAD التي كانت مماثلة لتلك التي لوحظت في البشر. كشف فحص مسارات التعبير الجيني في الفئران عن انخفاض التعبير عن الإنزيمات المشاركة في NAD من جديد مسار التوليف. في المقابل ، كانت تغييرات مماثلة غائبة في مسار الإنقاذ.
يقول الباحثون إن هذه النتائج تشير إلى أن إصابة الكلى لم تؤثر على وظيفة مسار الإنقاذ NAD.
وبالتالي ، يقترحون أن المكملات مع سلائف NAD التي يستخدمها مسار الإنقاذ يمكن أن تخفف من آثار إصابة الكلى.
في الواقع ، العلاج باستخدام NMN أو NR ، الذي بدأ مباشرة قبل حقن السيسبلاتين ، ساعد في تقليل آثار إصابة الكلى في الفئران. على وجه التحديد ، أدى التكميل مع NMN أو NR إلى علامات مرضية أقل لتلف النبيبات وانخفاض التعبير عن علامات إصابة الأنسجة وموت الخلايا في الأنابيب الكلوية. بالإضافة إلى ذلك ، ساعدت هذه السلائف NAD في تطبيع مستويات NAD في الكلى.
أدى علاج الفئران باستخدام السيسبلاتين إلى اختلال وظيفي في الميتوكوندريا وتزويدها بمكملات NAD المحمية ضد ضعف الميتوكوندريا وساعدت في تخفيف التغيرات في المسارات الأيضية.
أدت إصابة الكلى التي يسببها سيسبلاتين إلى زيادة التعبير الجيني المصاحب للالتهاب وتسلل أنسجة الكلى مع الخلايا المناعية. ساعدت مكملات السلائف NAD على تقليل هذه الاستجابات الالتهابية في الفئران المصابة بإصابة الكلى التي يسببها السيسبلاتين.
من بين الجينات المرتبطة بالالتهاب والتي أظهرت تعبيرًا مرتفعًا ، جينات للبروتينات مثل RIG-I التي يمكنها اكتشاف الحمض النووي الريبي الفيروسي في الخلية أثناء العدوى الفيروسية وتساعد في إثارة استجابة مناعية. لسابقة
وقال الباحثون إنه تماشيًا مع هذا ، وجدوا أن إصابة الكلى التي يسببها سيسبلاتين أدت إلى تسرب الحمض النووي الريبي من الميتوكوندريا ، مما أدى إلى تحفيزها لاحقًا. DDX58 تعبير. علاوة على ذلك ، أدى انخفاض مستويات NAD في خلايا الكلى للفئران المستزرعة عن طريق تثبيط إنزيم مشارك في تخليق NAD إلى زيادة في التعبير عن DDX58. في المقابل ، استعادت سلائف NAD مستويات NAD وحالت دون تسرب الحمض النووي الريبي من الميتوكوندريا إلى السيتوبلازم ، وبالتالي تثبيط تنشيط RIG-I.
وجد الباحثون أن مستويات NAD في الكلى البشرية كانت مرتبطة بمستويات التعبير DDX58، الجين الذي يشفر RIG-I ، والجينات الأخرى المشاركة في استشعار الحمض النووي الريبي الخلوي. فضلاً عن ذلك، DDX58 ارتبطت مستويات التعبير الجيني بانخفاض في وظائف الكلى وعلامات إصابة الكلى.
قال الباحثون إن هذه النتائج تشير إلى أن أمراض الكلى لدى البشر قد تؤدي أيضًا إلى انخفاض في مستويات NAD ، مما يتسبب في وقت لاحق في تنشيط مسار مشابه يتضمن تنشيط مسار استشعار الحمض النووي الريبي الخلوي والالتهاب.
يمكن لهذه النتائج أن تفيد في تطوير علاجات لأمراض الكلى ، وفقًا للدكتورة ديان تريولو ، أخصائية أمراض الكلى في مركز هولي نيم الطبي في تينيك ، نيو جيرسي.
وقالت “هذه الدراسة لديها القدرة على تغيير الطريقة التي نتعامل بها مع علاج أمراض الكلى” أخبار طبية اليوم. “اعتبارًا من الآن ، ركزت علاجاتنا على علاج الأمراض التي تؤثر على الكلى – على سبيل المثال ، تحسين السيطرة على مرض السكري وضغط الدم – لكن أطباء الكلى كانوا محدودًا في الموارد اللازمة لعلاج الكلى نفسها.”
“أظهرت هذه الدراسة مسارًا جديدًا محتملاً في العلاج من خلال تحديد نضوب NAD وكذلك إطلاق العصارة الخلوية من RNA للميتوكوندريا وتنشيط RIG-I كسبب لإصابة الكلى. من خلال تحديد هذه المسارات ، تحسن العلاج المستقبلي لأمراض الكلى بشكل كبير من خلال استهداف هذه المناطق وجلب الأمل والعلاجات المحتملة لملايين الأشخاص المتضررين “.
وأشار سوزتك إلى أن “هذا البحث الرائد يفتح آفاقًا جديدة لاستكشاف دور NAD في أمراض الكلى ويحتمل أن يمهد الطريق لعلاجات جديدة”. “في حين أن المزيد من التحقيق مطلوب ، فإن هذه النتائج توفر الأمل في التطورات المستقبلية في إدارة والوقاية من أمراض الكلى.”